无线通讯
汽车电子
汽车零部件检测
化学检测
电子烟检测
可靠性检测
电池检测
灯具检测
中国认证
亚洲认证
欧洲认证
北美认证
中东认证
澳洲认证
非洲认证
无线通讯产品注册备案
管理体系标准培训
无线类产品测试
SAR测试
OTA测试
音频/视频,信息和通信技术设备
逆变器
控制变压器和内装控制变压器的电源
医用电气设备
测量、控制和实验室用电气设备
(照明电器安规)机械
(照明电器安规)电学
智能家居产品检测
厨用家电测试
美容美发检测
日用家电检测
家用电器节能检测
汽车内外饰件(非电子电器件)—物理性能测试
汽车内外饰件(电子电器件)—IP防护
汽车电子电气件—电性能
汽车内外饰件 —机械性能测试
EMC测试
电性能测试
有害物质检测
消费品化学
生态纺织品检测
箱包鞋材检测
婴幼儿用品检测
机械类检测
温湿度及其他耐候性检测
电池检测
EMC检测
安全检测
消费品检测/通告服务-电子烟专篇
无线通讯
汽车电子
汽车零部件检测
化学检测
电子烟检测
可靠性检测
电池检测
灯具检测
中国认证
亚洲认证
欧洲认证
北美认证
中东认证
澳洲认证
非洲认证
无线通讯产品注册备案
管理体系标准培训
无线类产品测试
SAR测试
OTA测试
音频/视频,信息和通信技术设备
逆变器
控制变压器和内装控制变压器的电源
医用电气设备
测量、控制和实验室用电气设备
(照明电器安规)机械
(照明电器安规)电学
智能家居产品检测
厨用家电测试
美容美发检测
日用家电检测
家用电器节能检测
汽车内外饰件(非电子电器件)—物理性能测试
汽车内外饰件(电子电器件)—IP防护
汽车电子电气件—电性能
汽车内外饰件 —机械性能测试
EMC测试
电性能测试
有害物质检测
消费品化学
生态纺织品检测
箱包鞋材检测
婴幼儿用品检测
机械类检测
温湿度及其他耐候性检测
电池检测
EMC检测
安全检测
消费品检测/通告服务-电子烟专篇
无线通讯
汽车电子
汽车零部件检测
化学检测
电子烟检测
可靠性检测
电池检测
灯具检测
中国认证
亚洲认证
欧洲认证
北美认证
中东认证
澳洲认证
非洲认证
无线通讯产品注册备案
管理体系标准培训
无线类产品测试
SAR测试
OTA测试
音频/视频,信息和通信技术设备
逆变器
控制变压器和内装控制变压器的电源
医用电气设备
测量、控制和实验室用电气设备
(照明电器安规)机械
(照明电器安规)电学
智能家居产品检测
厨用家电测试
美容美发检测
日用家电检测
家用电器节能检测
汽车内外饰件(非电子电器件)—物理性能测试
汽车内外饰件(电子电器件)—IP防护
汽车电子电气件—电性能
汽车内外饰件 —机械性能测试
EMC测试
电性能测试
有害物质检测
消费品化学
生态纺织品检测
箱包鞋材检测
婴幼儿用品检测
机械类检测
温湿度及其他耐候性检测
电池检测
EMC检测
安全检测
消费品检测/通告服务-电子烟专篇
无线通讯
汽车电子
汽车零部件检测
化学检测
电子烟检测
可靠性检测
电池检测
灯具检测
中国认证
亚洲认证
欧洲认证
北美认证
中东认证
澳洲认证
非洲认证
无线通讯产品注册备案
管理体系标准培训
无线类产品测试
SAR测试
OTA测试
音频/视频,信息和通信技术设备
逆变器
控制变压器和内装控制变压器的电源
医用电气设备
测量、控制和实验室用电气设备
(照明电器安规)机械
(照明电器安规)电学
智能家居产品检测
厨用家电测试
美容美发检测
日用家电检测
家用电器节能检测
汽车内外饰件(非电子电器件)—物理性能测试
汽车内外饰件(电子电器件)—IP防护
汽车电子电气件—电性能
汽车内外饰件 —机械性能测试
EMC测试
电性能测试
有害物质检测
消费品化学
生态纺织品检测
箱包鞋材检测
婴幼儿用品检测
机械类检测
温湿度及其他耐候性检测
电池检测
EMC检测
安全检测
消费品检测/通告服务-电子烟专篇
无线通讯
汽车电子
汽车零部件检测
化学检测
电子烟检测
可靠性检测
电池检测
灯具检测
中国认证
亚洲认证
欧洲认证
北美认证
中东认证
澳洲认证
非洲认证
无线通讯产品注册备案
管理体系标准培训
无线类产品测试
SAR测试
OTA测试
音频/视频,信息和通信技术设备
逆变器
控制变压器和内装控制变压器的电源
医用电气设备
测量、控制和实验室用电气设备
(照明电器安规)机械
(照明电器安规)电学
智能家居产品检测
厨用家电测试
美容美发检测
日用家电检测
家用电器节能检测
汽车内外饰件(非电子电器件)—物理性能测试
汽车内外饰件(电子电器件)—IP防护
汽车电子电气件—电性能
汽车内外饰件 —机械性能测试
EMC测试
电性能测试
有害物质检测
消费品化学
生态纺织品检测
箱包鞋材检测
婴幼儿用品检测
机械类检测
温湿度及其他耐候性检测
电池检测
EMC检测
安全检测
消费品检测/通告服务-电子烟专篇
无线通讯
汽车电子
汽车零部件检测
化学检测
电子烟检测
可靠性检测
电池检测
灯具检测
中国认证
亚洲认证
欧洲认证
北美认证
中东认证
澳洲认证
非洲认证
无线通讯产品注册备案
管理体系标准培训
无线类产品测试
SAR测试
OTA测试
音频/视频,信息和通信技术设备
逆变器
控制变压器和内装控制变压器的电源
医用电气设备
测量、控制和实验室用电气设备
(照明电器安规)机械
(照明电器安规)电学
智能家居产品检测
厨用家电测试
美容美发检测
日用家电检测
家用电器节能检测
汽车内外饰件(非电子电器件)—物理性能测试
汽车内外饰件(电子电器件)—IP防护
汽车电子电气件—电性能
汽车内外饰件 —机械性能测试
EMC测试
电性能测试
有害物质检测
消费品化学
生态纺织品检测
箱包鞋材检测
婴幼儿用品检测
机械类检测
温湿度及其他耐候性检测
电池检测
EMC检测
安全检测
消费品检测/通告服务-电子烟专篇
无线通讯
汽车电子
汽车零部件检测
化学检测
电子烟检测
可靠性检测
电池检测
灯具检测
中国认证
亚洲认证
欧洲认证
北美认证
中东认证
澳洲认证
非洲认证
无线通讯产品注册备案
管理体系标准培训
无线类产品测试
SAR测试
OTA测试
音频/视频,信息和通信技术设备
逆变器
控制变压器和内装控制变压器的电源
医用电气设备
测量、控制和实验室用电气设备
(照明电器安规)机械
(照明电器安规)电学
智能家居产品检测
厨用家电测试
美容美发检测
日用家电检测
家用电器节能检测
汽车内外饰件(非电子电器件)—物理性能测试
汽车内外饰件(电子电器件)—IP防护
汽车电子电气件—电性能
汽车内外饰件 —机械性能测试
EMC测试
电性能测试
有害物质检测
消费品化学
生态纺织品检测
箱包鞋材检测
婴幼儿用品检测
机械类检测
温湿度及其他耐候性检测
电池检测
EMC检测
安全检测
消费品检测/通告服务-电子烟专篇
无线通讯
汽车电子
汽车零部件检测
化学检测
电子烟检测
可靠性检测
电池检测
灯具检测
中国认证
亚洲认证
欧洲认证
北美认证
中东认证
澳洲认证
非洲认证
无线通讯产品注册备案
管理体系标准培训
无线类产品测试
SAR测试
OTA测试
音频/视频,信息和通信技术设备
逆变器
控制变压器和内装控制变压器的电源
医用电气设备
测量、控制和实验室用电气设备
(照明电器安规)机械
(照明电器安规)电学
智能家居产品检测
厨用家电测试
美容美发检测
日用家电检测
家用电器节能检测
汽车内外饰件(非电子电器件)—物理性能测试
汽车内外饰件(电子电器件)—IP防护
汽车电子电气件—电性能
汽车内外饰件 —机械性能测试
EMC测试
电性能测试
有害物质检测
消费品化学
生态纺织品检测
箱包鞋材检测
婴幼儿用品检测
机械类检测
温湿度及其他耐候性检测
电池检测
EMC检测
安全检测
消费品检测/通告服务-电子烟专篇

MHRA更新电子烟和其他NCP作为药品的许可指南
作者:
立讯检测集团
来源:
http://www.lcs-cert.com/
发布时间:
2021-11-04
2021年10月29日,英国药品和保健品管理局(MHRA)在其政府官网上更新了其早前发布的《电子烟和其他吸入式含尼古丁产品(NCP)作为药品的许可指南》,这意味着英国可能率先成为全球第一个对医用电子烟实施医疗产品许可的国家。
该文件中指出,意图制造医用电子烟的厂商可联系MHRA提交医用电子烟产品许可申请,以通过与其他药品相同的监管批准程序。
我们将分三期为您详细解读该指南中的相关要求,本期介绍监管机构、产品要求概述和上市许可申请的内容。
监管机构:
MHRA不仅负责消费型电子烟的监管,也负责对作为医药产品的电子烟和含尼古丁产品(NCP)进行监管,旨在鼓励电子烟和其他吸入式NCP作为药物的许可,支持公司提交这些产品的营销授权申请。除了药品授权外,可再填充和重复使用的电子烟,还应符合已修订的2002年医疗器械法。
对于正在申请美国食品药品管理局(FDA)上市前烟草产品申请(PMTA)的产品申请人,MHRA 可以讨论哪些数据可能与英国上市许可申请相关。
产品要求概述:
a)应符合药品法规定义的质量、安全性和有效性标准;
b)还应符合相关的国家和国际标准组织制定的消费类电子烟的通用质量和安全标准;
c)根据具体产品的设计,可能还需要符合英国医疗器械法规;
d)可以大于TRPR规定的不超过20mg/mL的尼古丁含量、一次性电子烟/一次性烟弹不超过2mL的容量或再填充容器不超过10mL的容量。
上市许可申请(MAAs):
a)所有上市许可申请(MAAs)都必须得到风险管理计划的支持。这必须涵盖产品的已识别风险和潜在风险以及为将这些风险降至最低而要实施的措施,《良好药物警戒指南》(GpVP)中提供了更多信息;
b)在收集上市许可申请的档案时,需要考虑与药品质量、安全性和有效性相关的指南。该档案将需要遵《欧盟药品监管法》EudraLex第2卷-《人类用药品立法申请人须知和药品监管指南》中发布的格式。特别是第2B卷-档案的介绍和内容,提供了构成营销授权的数据的有用概述,并具体参考了在编译数据以支持营销授权时应参考的许多指南;
c)上市许可有多种途径,其中“国家150天程序”是一种快速程序,可用于高效申请在英国销售药物。
相关文章
最新文章
2025-12-12
2025-12-12
2025-12-12
资讯 | GB 6675《玩具安全》系列强制性国家标准2025版
2025-12-12
2025-12-12
资讯 | 11 月 30 日生效!俄罗斯获单方面暂停联盟其他国家所发证书在俄效力的权力
2025-12-12
2025-12-12
2025-12-12
2025-12-11
媒体中心
最新资讯
联系我们


服务热线
400-116-2629
立讯检测总部
电话:+(86) 0755-8259 1330
邮箱:webmaster@lcs-cert.com
地址:深圳市宝安区沙井街道衙边学子围巨基工业园 A栋1~2楼、C栋3楼

微信公众号
分享行业干货

微信咨询
请备注咨询服务

关注抖音

手机版网站
全国24小时服务热线
di投诉邮箱:customer.complaint@lcs-cert.com 投诉电话tel:18126445450 证书报告验证真伪邮箱: verification@lcs-cert.com
地址:深圳市宝安区沙井街道衙边学子围巨基工业园A栋1~2楼、C栋3楼 手机:18126505465 邮箱:webmaster@lcs-cert.com

 欧盟RED网络安全标准EN 18031
欧盟RED网络安全标准EN 18031
 无线及通信检测
无线及通信检测
 手机通讯产品认证
手机通讯产品认证
 蓝牙BQB产品认证
蓝牙BQB产品认证
 FM/AM产品认证
FM/AM产品认证
 WiFi产品认证
WiFi产品认证
 无线充电产品认证
无线充电产品认证
 对讲机类产品认证
对讲机类产品认证
 基站类认证
基站类认证
 SAR测试
SAR测试
 接收机产品认证
接收机产品认证
 5G NR产品认证
5G NR产品认证
 UWB产品认证
UWB产品认证
 物联网认证
物联网认证
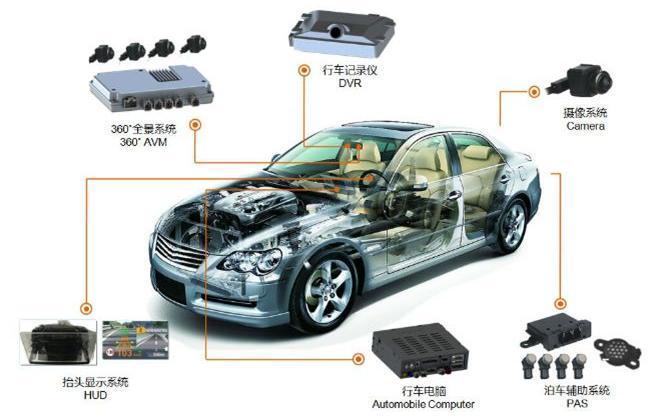 汽车电子EMC测试
汽车电子EMC测试
 EMC整改
EMC整改
 电磁兼容检测
电磁兼容检测
 电器性能测试
电器性能测试
 EMS测试-辐射抗干扰测试系统(含雷达波)
EMS测试-辐射抗干扰测试系统(含雷达波)
 EMS测试-静电放电
EMS测试-静电放电
 EMS测试-瞬态传导抗干扰测试
EMS测试-瞬态传导抗干扰测试
 EMS测试-便携式发射机抗扰
EMS测试-便携式发射机抗扰
 EMS测试-大电流注入(BCI)测试
EMS测试-大电流注入(BCI)测试
 EMS测试-低频磁场抗干扰测试
EMS测试-低频磁场抗干扰测试
 EMI测试-瞬态传导发射测试系统
EMI测试-瞬态传导发射测试系统
 EMI测试-低频磁场发射
EMI测试-低频磁场发射
 EMI测试-辐射发射测试
EMI测试-辐射发射测试
 EMI测试-传导发射测试
EMI测试-传导发射测试
 汽车电子检测
汽车电子检测
 汽车VOC
汽车VOC
 可靠性测试
可靠性测试
 温度冲击试验测试
温度冲击试验测试
 振动测试
振动测试
 仪表台/仪表盘三综合振动试验
仪表台/仪表盘三综合振动试验
 车门内板三综合振动试验测试
车门内板三综合振动试验测试
 遮阳板三综合振动试验测试
遮阳板三综合振动试验测试
 扰流板三综合振动试验测试
扰流板三综合振动试验测试
 汽车前后保险杠三综合振动试验
汽车前后保险杠三综合振动试验
 灯壳/灯罩三综合振动试验
灯壳/灯罩三综合振动试验
 外侧围三综合振动试验
外侧围三综合振动试验
 汽车金属材料测试
汽车金属材料测试
 汽车灯具性能测试
汽车灯具性能测试
 快速温变试验
快速温变试验
 振动试验
振动试验
 振动测试常见问题
振动测试常见问题
 疲劳测试常见问题
疲劳测试常见问题
 高低温测试常见问题
高低温测试常见问题
 传导干扰(CE)-苏州立讯标准
传导干扰(CE)-苏州立讯标准
 电磁辐射耐受测试(RS)-苏州立讯标准
电磁辐射耐受测试(RS)-苏州立讯标准
 电性快速脉冲耐受测试(EFT)-苏州立讯标准
电性快速脉冲耐受测试(EFT)-苏州立讯标准
 电压闪烁测试-苏州立讯标准
电压闪烁测试-苏州立讯标准
 家用电器产品检测
家用电器产品检测
 电器附件产品检测
电器附件产品检测
 家用电器检测
家用电器检测
 PFAS测试介绍
PFAS测试介绍
 MOSH/MOAH矿物油检测服务
MOSH/MOAH矿物油检测服务
 MOSH/MOAH矿物油检测认证报告服务
MOSH/MOAH矿物油检测认证报告服务
 消费品检测服务—WEEE篇
消费品检测服务—WEEE篇
 生态纺织品检测
生态纺织品检测
 食品接触材料检测
食品接触材料检测
 玩具及婴幼儿用品检测
玩具及婴幼儿用品检测
 有害物质检测
有害物质检测
 电子烟检测
电子烟检测
 可靠性HAST介绍
可靠性HAST介绍
 其他检测-铅笔硬度测试
其他检测-铅笔硬度测试
 机械类检测-包装抗压试验
机械类检测-包装抗压试验
 气候环境测试-氙灯老化试验
气候环境测试-氙灯老化试验
 动力储能电池检测认证
动力储能电池检测认证
 消费电子类电池检测认证
消费电子类电池检测认证
 动力电池
动力电池
 轻型电动车辆电池
轻型电动车辆电池
 储能电池
储能电池
 便携式电池
便携式电池
 电池类检测
电池类检测
 电池测试
电池测试
 船舶照明器具检测
船舶照明器具检测
 医疗室内照明COI指数测试
医疗室内照明COI指数测试
 灯具安规检测
灯具安规检测
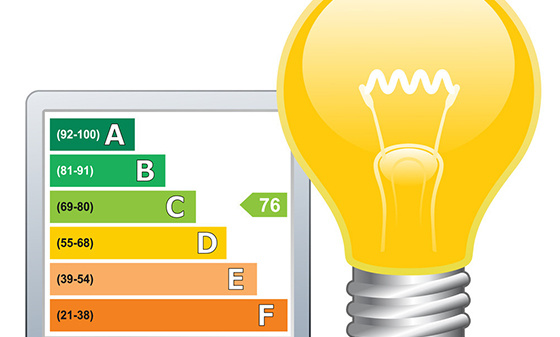 灯具能效检测
灯具能效检测
 积分球实验室
积分球实验室
 光生物实验
光生物实验
 光分布测试
光分布测试
 灯具老化测试
灯具老化测试
 灯具IP防水
灯具IP防水
 灯具性能检测
灯具性能检测
 灯具可靠性测试
灯具可靠性测试
 玩具产品检测标准
玩具产品检测标准
 管理体系培训
管理体系培训
 实验室技术培训
实验室技术培训
 实验室工艺咨询
实验室工艺咨询
 实验室装修建设
实验室装修建设




 扫码咨询
扫码咨询